|
|
市場調査レポート
商品コード
1871412
アジア太平洋の臨床試験市場レポート(2021年~2031年):範囲、セグメント、力学、競合分析Asia Pacific Clinical Trials Market Report 2021-2031 by Scope, Segmentation, Dynamics, and Competitive Analysis |
||||||
|
|||||||
| アジア太平洋の臨床試験市場レポート(2021年~2031年):範囲、セグメント、力学、競合分析 |
|
出版日: 2025年09月01日
発行: The Insight Partners
ページ情報: 英文 129 Pages
納期: 即納可能
|
概要
アジア太平洋の臨床試験の市場規模は、2023年の93億3,952万米ドルから2031年までに約167億6,221万米ドルに達すると予測されており、この期間におけるCAGRは7.6%となる見込みです。
エグゼクティブサマリーおよび市場分析
アジア太平洋(APAC)は、中国、日本、インド、韓国、オーストラリア、インドネシア、シンガポール、マレーシアなどの国々を含む、臨床試験市場において最も急速に成長している地域として認識されています。特に、オーストラリア、インド、韓国などの国々は、ヘルスケア分野の進歩により成長が見込まれています。これらの国々の政府は臨床試験を積極的に推進しており、慢性疾患の増加や臨床試験に対する認識の高まりと相まって、近い将来、市場参入企業にとって大きな機会が生まれると予想されます。
市場セグメンテーション分析
アジア太平洋の臨床試験市場は、研究デザイン、適応症、フェーズタイプに基づいて区分できます:
- 研究デザイン:市場は介入試験と拡大アクセス試験に区分され、2023年時点では介入試験が市場シェアの大半を占めています。
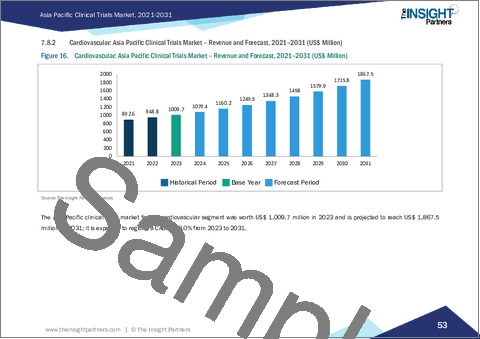
- 適応症:主要セグメントには、自己免疫疾患・炎症、疼痛管理、腫瘍学、神経疾患、糖尿病、肥満、代謝障害、心血管疾患などが含まれます。2023年時点では腫瘍学が最大のセグメントでした。
- フェーズタイプ:市場は第I相、第II相、第III相試験に分類され、2023年には第II相試験が最大の市場シェアを占めました。
市場展望
研究開発は、医薬品、バイオ医薬品、医療機器産業において極めて重要な役割を担い、医療的・商業的潜在価値の高い新たな治療ソリューションの開発を促進します。医薬品セクターは世界的に最も研究開発(R&D)集約的な産業の一つであり、患者ニーズへの対応において効果性と効率性の向上を追求しています。医薬品コストの上昇を受け、製薬企業はコスト目標達成のためR&Dへの大規模投資を進めています。過去10年間で新薬の年間承認率は上昇しており、新製品の創薬・試験・生産ならびに規制順守の確保には研究開発費が不可欠です。
PhRMA加盟企業による2021年の報告書によれば、上位15社の製薬企業は合計1,330億米ドルを研究開発に投資し、その約44%が臨床試験に充てられました。これらの企業と病院との連携により、免疫疾患を含む様々な疾患の治療法開発が進められています。例えば、2021年6月には武田薬品工業が、慢性炎症性脱髄性多発根神経炎(CIDP)治療薬「HYQVIA」の評価を目的としたADVANCE-1試験を開始しました。
国別洞察
アジア太平洋の臨床試験市場には、中国、日本、インド、オーストラリア、韓国、インドネシア、マレーシア、シンガポールなどの主要国が含まれます。中国は2023年に最大の市場として台頭しました。その背景には、確立された製薬セクター、研究開発費の増加、低コストによる臨床試験件数の増加、そして支援的な規制枠組みがあります。世界第2位の医薬品市場を有する中国では、膨大な人口と伝染性疾患・非伝染性疾患の両方の発生率上昇が製薬産業の成長を促進しており、臨床試験の主要な実施地となっています。
中国が医薬品臨床試験を支援する姿勢は、新薬開発を加速させています。「中国における新薬登録のための臨床試験進捗に関する年次報告書」によれば、登録された臨床試験件数は2021年の3,358件から2023年には4,300件へと着実に増加しています。さらに500の生物学的製剤が承認され、腫瘍学、皮膚科学、内分泌学が主要な治療領域となっています。また、製品開発期間とコスト削減を目指す国際製薬企業にとって、中国は魅力的な研究開発アウトソーシング先となっています。中国における臨床試験への欧米企業の参画は、2010年の年間約100件から2021年には約350件に増加しました。
近年、中国製薬業界は新薬開発に向けた研究開発に注力しています。例えば2021年には、ニュアンス・ファーマがヴェローナ・ファーマと提携し、エンシフェントリンの中国本土における開発を進めています。また2023年4月には、慢性閉塞性肺疾患(COPD)の維持治療として、同薬剤の第III相臨床試験を開始しました。
企業プロファイル
臨床試験市場の主要企業には、IQVIAホールディングス、パレクセル・インターナショナル、IXICO、チャールズリバーラボラトリーズ、ICON、ウーシー・アプテック、SGS、シネオス・ヘルス、サーモフィッシャーサイエンティフィック、ラボラトリー・コーポレーション・オブ・アメリカ、クリニリックス・リサーチ、カイディア、オラクル、メドペース、SIROクリンプファーマなどが挙げられます。これらの企業は、事業拡大、製品革新、合併・買収など様々な戦略を駆使し、市場での存在感を高め、革新的なソリューションを提供しています。
目次
第1章 イントロダクション
第2章 エグゼクティブサマリー
- 主な洞察
- 市場の魅力
第3章 調査手法
- 2次調査
- 1次調査
- 仮説の策定
- マクロ経済要因分析
- 基準値の開発
- データの三角測量
- 国レベルデータ
- 前提条件と制限事項
第4章 アジア太平洋の臨床試験市場情勢
- PEST分析
- エコシステム分析
- バリューチェーンにおけるベンダー一覧
第5章 アジア太平洋の臨床試験市場:主要な市場力学
- アジア太平洋の臨床試験市場:主要な市場力学
- 市場促進要因
- 市場抑制要因
- 市場機会
- 将来の動向
促進要因と抑制要因の影響:
第6章 アジア太平洋の臨床試験市場:分析
- アジア太平洋の臨床試験市場の収益、2021~2031年
- アジア太平洋の臨床試験市場予測分析
第7章 アジア太平洋の臨床試験市場分析:研究デザイン別
- 介入試験
- 拡大アクセス試験
第8章 アジア太平洋の臨床試験市場分析:適応症別
- 自己免疫疾患・炎症
- 疼痛管理
- 腫瘍学
- 神経疾患
- 糖尿病
- 肥満
- 代謝障害
- 心血管疾患
- その他
第9章 アジア太平洋の臨床試験市場分析:フェーズタイプ別
- 第I相
- 第II相
- 第III相
第10章 アジア太平洋の臨床試験市場:国別分析
- アジア太平洋
- 中国
- 日本
- インド
- オーストラリア
- 韓国
- インドネシア
- マレーシア
- シンガポール
- アジア太平洋のその他諸国
第11章 競合情勢
- 主要企業によるヒートマップ分析
- 企業のポジショニングと集中度
第12章 業界情勢
- 市場イニシアチブ
- 提携および協力関係
- その他の動向
第13章 企業プロファイル
- IQVIA Holdings Inc
- Parexel International Corp
- IXICO Plc
- Charles River Laboratories International Inc
- ICON Plc
- WuXi AppTec Co Ltd
- SGS SA
- Syneos Health Inc
- SIRO Clinpharm Pvt Ltd
- Thermo Fisher Scientific Inc
- Laboratory Corp of America Holdings
- CliniRx Research Private Limited
- Caidya
- Oracle Corp
- Medpace Holdings Inc