|
|
市場調査レポート
商品コード
1819689
欧州のファーマコビジランス・医薬品安全性ソフトウェア市場レポート(2021年~2031年):範囲、セグメント、力学、競合分析Europe Pharmacovigilance and Drug Safety Software Market Report 2021-2031 by Scope, Segmentation, Dynamics, and Competitive Analysis |
||||||
|
|||||||
| 欧州のファーマコビジランス・医薬品安全性ソフトウェア市場レポート(2021年~2031年):範囲、セグメント、力学、競合分析 |
|
出版日: 2025年07月10日
発行: The Insight Partners
ページ情報: 英文 224 Pages
納期: 即納可能
|
概要
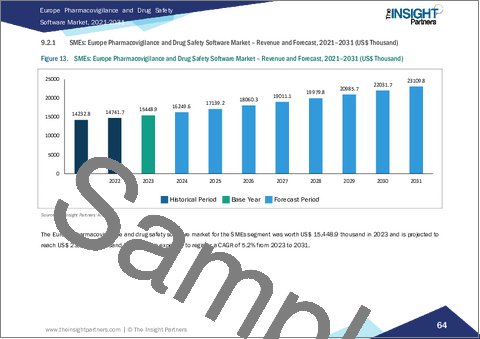
欧州のファーマコビジランス・医薬品安全性ソフトウェア市場は、2023年には約5,238万米ドルと評価され、2031年までには8,467万米ドルに成長すると予測されており、この間の年間平均成長率(CAGR)は6.2%です。
ファーマコビジランスのグローバル化-市場成長のカタリスト
医薬品副作用(ADR)のモニタリングと評価を含むファーマコビジランスは、医薬品規制、臨床実践、公衆衛生への取り組みにおいて重要な側面です。ファーマコビジランスのグローバル化は、規制当局、ヘルスケアプロバイダー、製薬企業など、さまざまな利害関係者間の連携強化を促進しています。例えば、欧州医薬品庁(EMA)は、医薬品の安全性、検査、関連情報の交換に焦点を当てた医薬品規制当局間の国際協力の重要性をますます強調しています。この協力的な枠組みは、データの共有を促進するだけでなく、医薬品の安全性プロファイルの全体的な理解を向上させます。
企業がこのようなグローバルなネットワークを活用することを目指しているため、国境を越えて効果的に機能する統合ファーマコビジランス・ソリューションに対する需要が顕著になってきています。世界各国の政府は、医薬品安全性の確保におけるファーマコビジランスの重要な役割を認識し、各国の規制機関と連携してファーマコビジランス・プログラムを実施しています。各国におけるファーマコビジランスのベストプラクティスに対する認識と採用の高まりは、専門的なソフトウェアソリューションに対する需要を著しく高めています。特筆すべき例として、イタリアの医療機関が挙げられます。同機関は2022年6月、ADRの疑いを検出するための全国ファーマコビジランス・ネットワーク(RNF)を立ち上げました。このシステムには、ADR報告を管理・分析するための高度な機能が組み込まれており、医薬品の安全性を正確に評価することができます。さらに、欧州各国で利用されているEudraVigilanceシステムは、ADRの疑いに関するレポートを作成し、ファーマコビジランスの取り組みをさらに強化します。
ファーマコビジランスのグローバル化は、国境を越えた連携も促進します。BeNeLuxA、北欧の共同研究、バレッタ宣言など、欧州のいくつかのイニシアチブは、革新的な治療法への患者のアクセスを改善することを目的としています。例えばBeNeLuxAイニシアチブは、ベルギー、オランダ、ルクセンブルグ、オーストリア、アイルランド間の協力を強化し、中所得国がより良い薬価交渉を行い、政策の専門知識を共有できるようにするものです。こうした協力的な取り組みは、包括的な医療技術評価を支援し、医薬品マーケティングの透明性を向上させます。ADRを世界規模で管理・報告できる強固なファーマコビジランス・システムの確立は、ファーマコビジランスのグローバル化を進める上で不可欠であり、ファーマコビジランス・医薬品安全性ソフトウェア市場の成長を促進しています。
欧州のファーマコビジランス・医薬品安全性ソフトウェア市場の概要
欧州のファーマコビジランス・医薬品安全性ソフトウェアの需要の増加は、厳しい規制要件、医薬品承認の増加、患者の安全性への関心の高まり、技術の進歩など、いくつかの要因に起因しています。EUのファーマコビジランスの枠組みは世界的に見ても最も洗練されており、EMAのような規制機関が厳格なファーマコビジランス基準を実施しているため、先進的なソフトウェアソリューションの導入が必要となっています。EUファーマコビジランス指令(2010/84/EU)および規則(EU)No 1235/2010は、ADRに対するより厳格な監視規則を導入し、安全性データをリアルタイムで報告することを企業に義務付け、大量のデータを処理できる効率的なソフトウェアシステムの必要性を高めています。
欧州の製薬部門では新薬の承認が急増し、安全性データを効率的に監視するファーマコビジランス・医薬品安全性ソフトウェアの需要がさらに高まっています。例えば、2023年第2四半期には、EMAと米国FDAは21以上の新がん治療薬を承認しました。より多くの製品が市場に投入される中、製薬会社はこれらの医薬品の安全性と有効性を確保するための堅牢なソフトウェアソリューションを必要としています。Oracle Corpなどの大手企業は、新たに承認された製品の安全性監視機能を強化するため、ファーマコビジランス・ソフトウェアに多額の投資を行っており、Oracle Argus SafetyやVeeva Vault Safetyなどのプラットフォームを活用して、効果的な有害事象管理を行っています。
さらに、欧州各国政府は、特にEU一般データ保護規則(GDPR)の導入に伴い、ソフトウェアデータを保護するためのコンプライアンス対策を実施しています。この規制は、ファーマコビジランス・医薬品安全性ソフトウェアが規制基準を満たすだけでなく、データプライバシーを保護しながら業務効率を確保することを義務付けています。GDPRを遵守することは、患者や規制機関との信頼関係を維持する上で極めて重要であり、それによって欧州全域でファーマコビジランス・ソフトウェアの導入が促進されます。
人工知能(AI)、機械学習(ML)、その他の先端技術の統合は、ファーマコビジランスプロセスに革命をもたらしています。これらの技術革新は、自動データ処理、リアルタイムのシグナル検出、高度な分析を容易にし、安全性データの管理と規制要件の遵守を簡素化します。例えば、ArisGlobalのLifeSphereプラットフォームは、AIを活用して症例処理を自動化し、シグナル検出機能を強化しており、欧州のファーマコビジランス・医薬品安全性ソフトウェアの需要をさらに促進しています。
市場セグメンテーション分析
欧州のファーマコビジランス・医薬品安全性ソフトウェア市場は、オファリン、展開、企業規模、形態、機能、エンドユーザー、国などのさまざまな基準に基づいてセグメント化されます。
- オファリング:市場はソフトウェアとサービスに分けられ、2023年にはソフトウェア分野が大きなシェアを占めました。
- 展開:クラウドソリューションとオンプレミスソリューションに分類され、2023年はクラウドソリューションが優位を占めました。
- 企業規模:市場は大企業と中小企業に区分され、大企業が大きなシェアを占めました。
- 形態:市場は標準ソリューションとカスタマイズソリューションに分類され、標準ソリューションが市場シェアで優位を占めました。
- 機能:市場には、シグナル・リスク管理、課題追跡、ケース管理などが含まれ、シグナル・リスク管理が最大のセグメントとなっています。
- エンドユーザー:市場は製薬・バイオテクノロジー企業、調査受託機関、BPO企業に分類され、製薬・バイオテクノロジー企業が主要企業となっています。
- 国別:市場はドイツ、フランス、英国、イタリア、スペイン、その他欧州に区分され、2023年の市場シェアはドイツが圧倒的です。
市場の主要企業
欧州のファーマコビジランス・医薬品安全性ソフトウェア市場の主要企業には、Veeva Systems Inc、IQVIA Holdings Inc、AB Cube S.A.S.、ArisGlobal LLC、Oracle Corp、Max Application、ICON Plc、Cognizant Technology Solutions Corp、Accenture Plc、Syneos Health Inc、Genpact Ltd.、Laboratory Corp of America Holdings、Parexel International Corp、Qinecsa Solutions、Clinevo Technologiesなどがあります。
目次
第1章 イントロダクション
第2章 エグゼクティブサマリー
- 主要洞察
- 市場の魅力
第3章 調査手法
- 2次調査
- 1次調査
- 仮説の策定
- マクロ経済要因分析
- 基礎数値の開発
- データの三角測量
- 国レベルのデータ
第4章 欧州のファーマコビジランス・医薬品安全性ソフトウェア市場情勢
- 概要
- エコシステム分析
- ソフトウェア/サービスプロバイダー
- システムインテグレーター
- 規制機関
- エンドユーザー
- バリューチェーンのベンダー一覧
第5章 欧州のファーマコビジランス・医薬品安全性ソフトウェア市場:主要市場力学
- 市場促進要因
- 市場抑制要因
- 市場機会
- 今後の動向
- 促進要因と阻害要因の影響
第6章 欧州のファーマコビジランス・医薬品安全性ソフトウェア市場-分析
- 欧州のファーマコビジランス・医薬品安全性ソフトウェア市場収益、2021年~2031年
- 欧州のファーマコビジランス・医薬品安全性ソフトウェア市場予測分析
第7章 欧州のファーマコビジランス・医薬品安全性ソフトウェアの市場分析-オファリング別
- ソフトウェア
- サービス
第8章 欧州のファーマコビジランス・医薬品安全性ソフトウェアの市場分析-展開別
- クラウド
- オンプレミス
第9章 欧州のファーマコビジランス・医薬品安全性ソフトウェアの市場分析-企業規模別
- 大企業
- 中小企業
第10章 欧州のファーマコビジランス・医薬品安全性ソフトウェアの市場分析-形態別
- 標準
- カスタマイズ
第11章 欧州のファーマコビジランス・医薬品安全性ソフトウェアの市場分析-機能別
- シグナルとリスク管理
- 問題追跡と有害事象追跡
- 症例管理
- 臨床安全性管理・臨床試験安全性
- 品質とコンプライアンス
- メディカルライティング
- 監査サポートとトレーニングコンプライアンス
- ヘルスケア分析
- その他
第12章 欧州のファーマコビジランス・医薬品安全性ソフトウェア市場分析-エンドユーザー別
- 製薬会社・バイオテクノロジー企業
- 契約研究機関
- ビジネスプロセスアウトソーシング(BPO)企業
- その他
第13章 欧州のファーマコビジランス・医薬品安全性ソフトウェア市場:国別分析
- 欧州
- ドイツ
- フランス
- 英国
- イタリア
- スペイン
- その他欧州
第14章 競合情勢
- ヒートマップ分析:主要企業別
- 企業のポジショニングと集中度
第15章 業界情勢
- 市場イニシアティブ
- パートナーシップとコラボレーション
第16章 企業プロファイル
- ArisGlobal LLC
- Max Application
- Oracle Corp
- Veeva Systems Inc
- IQVIA Holdings Inc
- ICON Plc
- Cognizant Technology Solutions Corp
- Accenture Plc
- Syneos Health Inc
- Genpact Ltd.
- AB Cube S.A.S.
- Laboratory Corp of America Holdings
- Parexel International Corp
- Qinecsa Solutions
- Clinevo Technologies