
|
市場調査レポート
商品コード
1836659
ファーマコビジランス:市場シェア分析、産業動向、統計、成長予測(2025年~2030年)Pharmacovigilance - Market Share Analysis, Industry Trends & Statistics, Growth Forecasts (2025 - 2030) |
||||||
カスタマイズ可能
適宜更新あり
|
|||||||
| ファーマコビジランス:市場シェア分析、産業動向、統計、成長予測(2025年~2030年) |
|
出版日: 2025年06月27日
発行: Mordor Intelligence
ページ情報: 英文 125 Pages
納期: 2~3営業日
|
概要
ファーマコビジランス市場は、2025年に93億5,000万米ドルと評価され、CAGR 11.98%で進展し、2030年には164億7,000万米ドルに達すると予測されています。
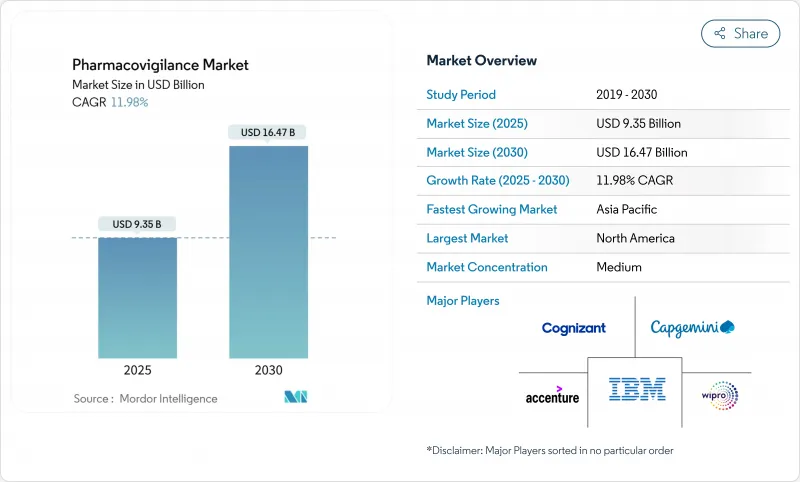
医薬品パイプラインの拡大、市販後調査規則の厳格化、安全性監視ワークフローへの人工知能(AI)の急速な導入がこの勢いを支えています。製薬会社は、生物製剤、遺伝子治療、その他の複雑な治療法が商業的に使用されるようになるにつれて、積極的な安全性管理にリソースを振り向けています。クラウドベースのAIプラットフォームを備えたCRO(医薬品開発業務受託機関)は、コスト効率の高いコンプライアンスを提供し、アウトソーシングシフトを加速させています。市販後調査義務によりデータ量が増大し、電子カルテ(EHR)のマイニングが最も急成長している報告方法となっています。北米は成熟した規制科学により主導権を維持しているが、アジア太平洋(APAC)のハーモナイゼーション・イニシアチブが同地域の2桁成長を後押ししています。
世界のファーマコビジランス市場の動向と洞察
医薬品消費と開発パイプラインの増加
FDAは2024年に50の新しい分子実体を承認し、画期的な承認がすべてのスポンサーにとって市販後の安全性義務をいかに拡大するかを強調しています。遺伝子治療薬、CAR-T治療薬、配合剤は、製品のライフサイクルを通じて注意深いモニタリングを必要とするユニークなリスクプロファイルをもたらします。条件付き承認はさらにリアルワールドエビデンス(RWE)への期待を高め、継続的な監視インフラに予算を振り向ける。このような力学により、ファーマコビジランスチームは、臨床開発を超えて仕事量の増加を維持する長期的な拡大サイクルに組み込まれることになります。
副作用(ADR)の増加
欧州医薬品庁(EMA)のファーマコビジランスリスク評価委員会(PRAC)は最近、二次悪性腫瘍の可能性を観察した後、CAR-Tレシピエントの生涯モニタリングを強調しました。高齢者集団におけるポリファーマシーは薬物-薬物相互作用を増加させ、ADR症例数を増加させる。パンデミック時代のワクチン展開は、数百万件の安全性報告を数週間以内に処理できる大規模シグナル検出ネットワークの重要性を検証しました。
サイバーセキュリティとデータプライバシーのリスク
機密性の高い患者データのクラウド展開により、安全性システムはランサムウェアや国家による侵入にさらされます。最近のヘルスケア侵害により、いくつかのスポンサーはEHR統合の一時停止を余儀なくされたが、その一方で監査により安全性シグナル操作が行われていないことが確認されました。一般データ保護規則(GDPR)や同様の法律は、データの最小化やローカライズ戦略を義務付けており、グローバルなアナリティクスの野心と相反する場合があります。
レポートで分析されているその他の促進要因と抑制要因
- CRO/BPOベンダーへのPVサービスのアウトソーシング
- AIによるシグナル検出と予測分析
- PV専門人材の不足と高い離職率
セグメント分析
フェーズIV試験は2024年にファーマコビジランス市場シェアの32.18%を占め、革新的治療の生涯モニタリングに対する規制当局の需要を反映しています。前臨床安全性評価に付随するファーマコビジランス市場規模は、リスクベースの初期段階分析により13.13%のCAGRで拡大すると予測されます。適応試験デザインはフェーズIIとフェーズIIIを短縮するが、製品が広範な集団に投与されるようになると、忠実度の高いシグナル検出の重要性が高まる。更新されたICH E6(R3)ガイドラインは、スポンサーに対し、全相に亘りquality-by-designの指標を組み込むことを強制し、ヒトへの初回投与から追跡可能な安全性データの取得を保証します。
ファーマコビジランス市場は、患者への直接サンプリングやウェアラブルセンサーを用いた分散型試験を統合することで対応しています。AIモデルは、初回患者投与前に標的外影響をシミュレーションし、企業にリスク管理計画を先取りさせる。条件付き承認が増加するにつれ、承認後安全性試験(PASS)の予算は従来のフェーズIIIの支出を上回り、フェーズIVの優位性が長期的な見通しに固定されます。
アウトソーシング契約は、2024年に全体の収益の55.46%を占め、2030年まで13.73%で成長すると予測され、ファーマコビジランス市場で最大のスライスを維持しています。自社部門は重要な意思決定を維持するが、CROプラットフォームが定型業務を処理するハイブリッドモデルへの依存度が高まっています。パレクセルのパランティアとの複数年にわたるAI提携のような戦略的提携は、技術強化されたCROがいかに競争力を培うかを例証しています。
ファーマコビジランス業界では現在、スケーラブルなデータレイク、科学文献の自然言語処理(NLP)、インテークにおけるロボットによるプロセス自動化が重視されています。その結果、大手製薬会社でさえ、ワークロードをインド、アイルランド、東欧の外部ハブに移行し、断片的なベンダーリストをAI投資のロードマップを保証する基本サービス契約に統合しています。
地域別分析
北米は2024年にファーマコビジランス市場の44.18%を占めるが、これは高い研究開発強度、高度なEHRの普及、明確な規制上の期待によるものです。FDAが段階的な検証フレームワークを公表したことで、AIパイロットが急速に受け入れられ、この地域がデジタルファーマコビジランスの世界的な基準として位置づけられます。
欧州は、EudraVigilanceネットワークを支える成熟した法律と、アルゴリズムの透明性を要求する一方でイノベーションを奨励する新しいAI反映ペーパーで追随します。先進治療薬への注力により、専門的なモニタリングニーズがもたらされ、2030年まで投資が持続します。EUベースのPASSのファーマコビジランス市場規模は、希少疾病用医薬品の承認とともに成長します。
アジア太平洋地域のCAGRは13.64%で、世界最速と予測されます。これは中国の規制改革とインドの臨床試験状況の拡大に伴うものです。ASEAN諸国は表示と電子申請の基準を合わせ、複数国での安全性キャンペーンを簡素化します。国内のバイオテクノロジー製造業への投資が、現地に根ざした症例処理ハブへの需要を刺激します。中東・アフリカと南米は、医薬品の輸入量や新興の製造クラスターに合わせてファーマコビジランス・インフラの規模を拡大し、さらなる成長を遂げます。
その他の特典:
- エクセル形式の市場予測(ME)シート
- 3ヶ月間のアナリストサポート
よくあるご質問
目次
第1章 イントロダクション
- 調査の前提条件と市場定義
- 調査範囲
第2章 調査手法
第3章 エグゼクティブサマリー
第4章 市場情勢
- 市場概要
- 市場促進要因
- 医薬品消費量と開発パイプラインの増加
- 副作用(ADRS)の増加
- CRO/BPOベンダーへのPvサービスのアウトソーシング
- AIによるシグナル検出と予測分析
- リアルワールドエビデンス(RWE)プラットフォームの拡大
- 積極的な市販後安全性調査に対する厳しい規制の義務化
- 市場抑制要因
- サイバーセキュリティとデータプライバシーのリスク
- グローバルな規制調和とデータ標準の欠如
- PV専門人材の不足と高い離職率
- 配合剤・ATMP療法の複雑性
- バリュー/サプライチェーン分析
- 規制状況
- 技術展望
- ポーターのファイブフォース分析
- 供給企業の交渉力
- 買い手の交渉力
- 新規参入業者の脅威
- 代替品の脅威
- 競争企業間の敵対関係の強さ
第5章 市場規模および成長予測(金額-米ドル)
- 臨床試験フェーズ別
- 前臨床試験
- フェーズI
- フェーズII
- フェーズIII
- フェーズIV
- サービスプロバイダー別
- インハウス
- アウトソーシング契約
- 報告タイプ別
- 自発的報告
- ADR報告の強化
- 対象自発報告
- コホートイベントモニタリング
- EHRマイニング
- エンドユーザー別
- 病院
- 製薬会社
- CROおよびその他のエンドユーザー
- 地域別
- 北米
- 米国
- カナダ
- メキシコ
- 欧州
- ドイツ
- 英国
- フランス
- イタリア
- スペイン
- その他欧州
- アジア太平洋
- 中国
- 日本
- インド
- オーストラリア
- 韓国
- その他アジア太平洋地域
- 中東・アフリカ
- GCC
- 南アフリカ
- その他中東とアフリカ
- 南米
- ブラジル
- アルゼンチン
- その他南米
- 北米
第6章 競合情勢
- 市場集中度
- 市場シェア分析
- 企業プロファイル
- Accenture
- ArisGlobal
- BioClinica(NOW Clario)
- Capgemini
- Cognizant
- IBM
- ICON plc
- IQVIA
- ITClinical
- Labcorp
- Linical Accelovance
- Parexel
- UBC(United BioSource)
- TAKE Solutions(Navitas Life Sciences)
- Wipro
- Oracle Health Sciences
- Ennov
- Extedo
- Clarivate(Drug Safety Triager)
- SGS Life Sciences


