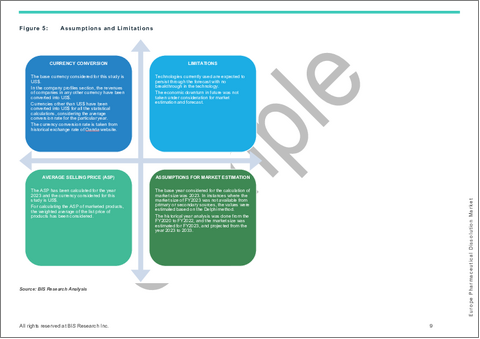
|
|
市場調査レポート
商品コード
1876450
欧州の医薬品溶出試験市場 - 分析と予測(2024年~2033年)Europe Pharmaceutical Dissolution Market: Analysis and Forecast, 2024-2033 |
||||||
カスタマイズ可能
|
|||||||
| 欧州の医薬品溶出試験市場 - 分析と予測(2024年~2033年) |
|
出版日: 2025年11月25日
発行: BIS Research
ページ情報: 英文 58 Pages
納期: 1~5営業日
|
概要
欧州の医薬品溶出試験の市場規模は、2024年の2億860万米ドルから2033年までに4億950万米ドルに達すると予測されており、2024年から2033年の予測期間においてCAGR 7.78%で成長する見込みです。
医薬品溶出試験とは、錠剤、カプセル、粉末などの医薬品が、通常は生理的体液を模擬した液体媒体中で溶解し、有効成分(API)を放出する過程を指します。この過程は、生物学的利用能に直接影響を与え、有効成分が血流に入る速度と程度を決定するため、人体内での薬剤の挙動を理解する上で基礎的な役割を果たします。溶出試験は、欧州全域における医薬品開発および品質管理の基盤として機能し、医薬品が欧州医薬品庁(EMA)および各国規制当局が求める厳格な安全性、有効性、および均一性の基準を満たすことを保証します。経口剤形の特性評価と最適化に不可欠であると同時に、欧州市場全体における販売承認申請および継続的な規制順守のための重要なデータを生成します。
| 主要市場統計 | |
|---|---|
| 予測期間 | 2024年~2033年 |
| 2024年の評価 | 2億860万米ドル |
| 2033年の予測 | 4億950万米ドル |
| CAGR | 7.78% |
市場概要
欧州の医薬品溶出試験市場は、医薬品品質管理および医薬品開発分野において重要な役割を担っており、同地域全体における医療製品の安全性、有効性、規制順守を保証しています。医薬品溶出試験は、錠剤、カプセル、粉末などの製剤が生理学的環境を模擬した条件下で有効成分(API)をどのように溶出試験させるかを測定することにより、生体内での薬剤の性能と生物学的利用能を予測する重要な情報を提供します。
欧州医薬品庁(EMA)および各国規制当局による強力な規制枠組みが特徴の欧州の高度な製薬産業により、洗練された溶出試験装置およびサービスに対する需要が高まっています。初期製剤開発から商業生産、品質管理に至る医薬品ライフサイクル全体において、同地域には多国籍製薬企業、ジェネリック医薬品メーカー、受託研究機関、学術研究機関が多数存在し、これらは溶出試験に大きく依存しています。
関連メディア、付属品、分析サービスに加え、市場には自動化システム、手動装置、特殊な生体関連溶出試験装置など、多様な溶出試験機器が含まれます。ドイツ、フランス、英国、イタリア、スイスは、欧州の医薬品生産・研究に大きく貢献する重要な市場です。
欧州の医薬品溶出試験業界は、厳格な規制、ジェネリック医薬品開発の拡大、製薬分野における研究開発投資の増加、手順の技術的進歩により、絶えず変化しています。品質設計(QbD)コンセプトの導入、自動化技術、生体関連手法の普及により、溶出試験は欧州全域において医薬品イノベーションと品質保証に不可欠なツールとなりつつあります。
市場セグメンテーション:
セグメンテーション1:地域別
- 欧州
- ドイツ
- 英国
- フランス
- イタリア
- スペイン
- その他
欧州医薬品溶出試験市場における動向、市場促進要因・課題
主な市場動向
- 医薬品品質管理における効率性向上、人的ミスの削減、規制順守の確保を目的とした自動溶出試験システムの採用拡大
- 生体内での薬剤の挙動を予測するため、生理的条件をより忠実に再現する生体関連溶出試験への移行が進んでいます
- データ分析、方法開発、予測モデリングのための溶出試験における人工知能(AI)と機械学習の統合が進んでいます
- 製薬企業が品質管理業務を外部委託する中、専門的な溶出試験サービスを提供する受託研究機関(CRO)の拡大
- 製剤開発における品質設計(QbD)原則への注目の高まりにより、溶出試験が医薬品開発の重要な要素となる
- スループット向上のため、複数サンプルの同時を可能とするマルチベッセル溶出試験システムへの需要増加
主な市場促進要因
- 欧州医薬品庁(EMA)および各国規制当局別厳格な規制要件により、医薬品承認およびバッチリリースに包括的な溶出試験が義務付けられていること
- 欧州におけるジェネリック医薬品の生産増加に伴い、ブランド品との生物学的同等性を実証するための広範な溶出試験が必要となっていること
- 欧州全域における製薬研究開発投資の増加により、製剤開発段階における溶出試験装置およびサービスの需要が高まっていること
- 徐放性製剤、持続性製剤、複合製剤など、薬剤製剤の複雑化が進み、高度な溶出試験手法が必要となっていること
- 拡大するバイオ医薬品分野において、複雑な生物学的製剤およびバイオシミラー向けの専門的な溶出試験アプローチが必要とされていること
- 欧州における高齢化が進み、医薬品消費量が増加するとともに、品質管理を必要とする医薬品製造が増加していること
主な課題
- 高度な自動溶出試験装置の導入には多額の資本投資が必要であり、中小製薬企業や研究所にとって障壁となっています
- ナノ粒子、リポソーム、経皮パッチなどの新規薬物送達システムに対する標準化された方法が不足しており、溶出試験プロトコルの複雑化を招いている
- 欧州市場全体において、高度な溶出試験技術と規制要件に関する訓練を受けた熟練人材の不足
- 生体内での性能を正確に予測しつつ規制上の受容性を維持する、生体関連性のある溶出試験法の開発における複雑さ
- 調和努力にもかかわらず欧州各国間で規制解釈にばらつきが生じ、多国籍企業におけるコンプライアンス対応に課題が生じる
- 溶出試験装置の保守・校正要件が時間とコストを要し、業務効率に影響を及ぼしていること
- 特に複雑な製剤や難溶性薬剤におけるin vitro-in vivo相関(IVIVC)の確立における課題
製品・イノベーション戦略:当レポートは、医薬品溶出試験における最新の技術的進歩に関する深い洞察を提供し、組織がイノベーションを推進し、市場のニーズに合わせた最先端製品を開発することを可能にします。
成長・マーケティング戦略:包括的な市場分析と主要な成長機会の特定を通じて、組織がターゲットを絞ったマーケティング戦略を策定し、効果的に市場での存在感を拡大するための知識を提供します。
競争戦略:当レポートには競合情勢の徹底的な分析が含まれており、組織が医薬品溶出試験性分野における競合他社の強みと弱みを理解し、市場で競争優位性を獲得するための効果的な戦略立案を支援します。
規制・コンプライアンス戦略:医薬品溶出試験に特化した進化する規制枠組み、承認状況、業界ガイドラインに関する最新情報を提供し、組織がコンプライアンスを維持し、新規医薬品溶出試験製品の市場参入を加速することを保証します。
投資および事業拡大戦略:市場動向、資金調達パターン、提携機会を分析することで、組織が情報に基づいた投資判断を行い、事業成長のための潜在的なM&A機会を特定することを支援します。
主要市場プレイヤーと競合要約
プロファイル対象企業は、主要専門家からの情報収集に加え、企業カバレッジ、製品ポートフォリオ、市場浸透度の分析に基づき選定されております。
本市場で確立された主要企業は以下の通りです。
- Merck KGaA
- Almac Group
- Sotax
目次
エグゼクティブサマリー
第1章 調査手法
第2章 医薬品溶出試験市場:概要
第3章 市場産業の展望
- 市場概要とエコシステム
- 市場機会評価
- 製品ベンチマーク
- 規制状況/コンプライアンス
- 欧州連合(EU)
第4章 医薬品溶出試験市場(地域別)、100万米ドル、2023年~2033年
- 地域サマリー
- 成長シェアマトリックス
- 欧州
- 地域概要
- 促進要因
- 抑制要因
- ドイツ
- 英国
- フランス
- イタリア
- スペイン
- その他
第5章 市場-競合情勢
- 競合ベンチマーキング
- 競合情勢
- 合併と買収
- 資金調達活動
- 主な発展分析
- 企業シェア分析、2023年
- 企業プロファイル(主要メーカー)
- Merck KGaA
- Sotax
- Almac Group
- サービスプロバイダー
- Eurofins Scientific
- Intertek Group plc
- Avivia BV