
|
市場調査レポート
商品コード
1850148
ファーマコビジランスと医薬品安全性ソフトウェア:市場シェア分析、産業動向、統計、成長予測(2025年~2030年)Pharmacovigilance And Drug Safety Software - Market Share Analysis, Industry Trends & Statistics, Growth Forecasts (2025 - 2030) |
||||||
カスタマイズ可能
適宜更新あり
|
|||||||
| ファーマコビジランスと医薬品安全性ソフトウェア:市場シェア分析、産業動向、統計、成長予測(2025年~2030年) |
|
出版日: 2025年06月23日
発行: Mordor Intelligence
ページ情報: 英文 120 Pages
納期: 2~3営業日
|
概要
ファーマコビジランスソフトウェア市場は、2025年に2億2,218万米ドルと評価され、2030年には2億9,356万米ドルに達すると予測され、CAGRは5.73%で着実に進展しています。
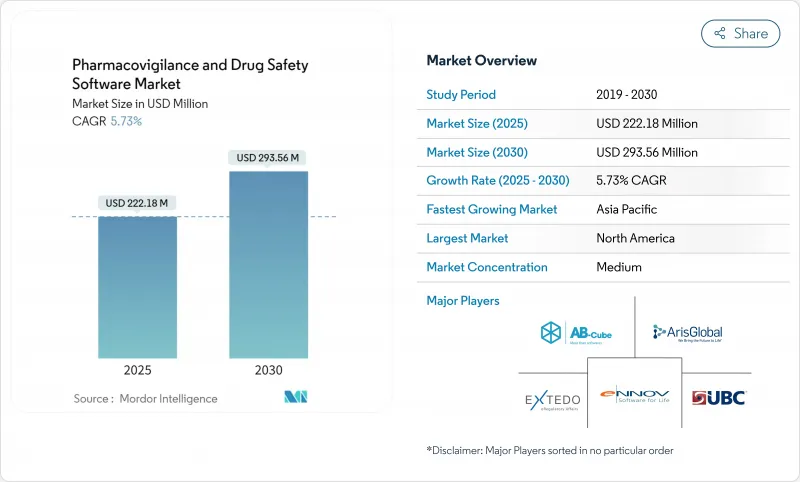
成長の軸となるのは、基本的なコンプライアンス・システムから、スポンサーが実世界のエビデンスをほぼリアルタイムで評価できるよう支援するAI対応の安全性インテリジェンス・プラットフォームへの移行です。FDAのE2B(R3)指令や欧州医療データスペース規制を筆頭に、世界的な報告ルールの調和が進み、規制の期限が非裁量的なIT支出に変換されます。ライフサイエンス企業におけるクラウドの普及率は80%を超え、最新の安全性データベースの好ましい展開基盤を構築しています。一方、症例のトリアージを自動化する説明可能なAIモジュールは、処理コストを50%も削減し、早期導入企業に経済的優位性をもたらします。アジア太平洋地域の地政学的安定は、合理化された倫理承認と相まって、臨床試験のシェアを東に移し、高度なサーベイランスツールに対する地域需要を高めています。
世界のファーマコビジランスと医薬品安全性ソフトウェア市場の動向と洞察
副作用(ADR)の発生率の上昇
新たな分子化合物が広く使用されるようになるにつれ、ADRの蔓延が加速し、高度なモニタリングに対する需要が再構築されています。Cureus Journalのデータによると、21-40歳の年齢層が最も高い頻度でADRを報告しており、これはポリファーマシーの増加と病院との相互作用の増加を反映しています。FDAは2024年に50の新規分子化合物を承認するため、スポンサーは多様な患者亜集団について、これまで見られなかった安全性シグナルをサーベイする必要があります。生物製剤と遺伝子治療は、遺伝的背景によって反応が異なる可能性があるため、複雑さを増しています。したがって、ファーマコビジランス・ソフトウェア市場は、静的な報告書リポジトリから、異種縦断的データセットを分析できる実世界のエビデンス・エンジンへとシフトしています。手作業では量と複雑さに対応できないため、AIを活用したパターン認識を報告ワークフローに組み込むベンダーが重要性を増しています。
厳しいグローバルE2B(R3)/IDMPコンプライアンス期限
2026年4月、FDAはE2B(R3)申請の締め切りを迎え、スポンサーは従来のR2フォーマットを放棄し、アップグレードされたプラットフォームへの投資を余儀なくされます。同時に、欧州医薬品庁(European Medicines Agency:EEA)のIDMP(European Medicines Agency:European Medicines Agency)展開により、医薬品データ要件が強化され、1つのスキーマでイベントと製品識別子の両方を管理することがソフトウェアに求められます。二重のシステムメンテナンスはリスクとオーバーヘッドを増大させるため、企業は法令に先駆けて移行を加速させる。このような規制の同期性により、コンプライアンス・アップグレードへの支出は裁量的な予算項目ではなく確実なものとなり、ファーマコビジランス・ソフトウェア市場の予測可能な成長を下支えしています。
データ主権と国境を越えた移転制限
2025年5月発効の欧州医療データ空間規則は、医療データの二次利用に新たな基準を設定し、ソフトウェアが尊重すべき同意層を導入します。GDPRはすでに外部処理を制限しており、アジアやラテンアメリカでも同様の枠組みが生まれつつあります。そのためベンダーは、データを国内に保持しつつ、非識別化されたシグナルをグローバルに共有する連携モデルを設計しなければならないです。このアーキテクチャはコストを上昇させ、展開サイクルを長期化させるため、ファーマコビジランス・ソフトウェア市場の拡大の一部を阻害することになります。
セグメント分析
有害事象報告ソフトウェアは、2024年のファーマコビジランス・ソフトウェア市場において40.7%という圧倒的なシェアを維持し、譲れないコンプライアンスの柱としての地位を強調しています。しかし、シグナル検出とリスク管理モジュールはCAGR18.4%で成長すると予測されており、規制当局が介入する前に異常を知らせる予防的分析に軸足を移していることを示しています。現在、多くのスポンサーは、インテーク、トリアージ、アナリティクス、および提出を1つのワークフローに統合する統合プラットフォームを好んでいます。オラクルは、2024年にArgusにAIを搭載した条件付きタッチレス処理を追加し、組み込みインテリジェンスがレガシーソリューションをいかに向上させるかを示しています。生物学的承認の継続的な増加は、多様な実世界のデータフィードと相まって、民族的、ゲノム的、および健康の社会的決定要因のデータセット間の相関関係を引き出すプラットフォームの機会を広げています。
統合されたスイートはまた、単一の品質管理システムが複数のモジュールをカバーするため、検証のオーバーヘッドを削減します。その結果、ポイント・ソリューションをエンド・ツー・エンド・アーキテクチャーに調和させることができるベンダーは、ニッチな競合他社よりも早く設置ベースを拡大しています。シグナル検出ユニットは、最終的にはイベント報告売上を上回るかもしれないが、規制当局への提出は依然としてソースとなる症例データに由来するため、両モジュールは依然として共生しています。したがって、高度な分析に起因するファーマコビジランス・ソフトウェアの市場規模は、レポーティングが基礎的な関連性を維持しているとしても、市場全体よりも急速に拡大することが予想されます。
地域分析
北米が2024年の収益シェア35.9%で首位を占め、FDAの厳しい監督と上位20社の製薬企業の密集がその要因となっています。ファイザーの使用事例は、自動トリアージと重複排除により150万件以上のCOVID-19ワクチン症例を処理しました。FDAが2025年にAI最高責任者を設置したことは、規制当局がアルゴリズムによる申請を評価する用意があることを強調するもので、AIを多用したアップグレードに対する地域の意欲を強めています。人材不足は依然としてハードルであり、データサイエンスのスペシャリストの給与は高騰し、中小企業はアウトソーシングを迫られています。
アジア太平洋地域は、韓国、台湾、シンガポールへの臨床試験の移行を背景に、CAGR最速の14.3%を記録しました。無錫AppTecを筆頭に拡大する中国の医薬品開発業務受託は、国家医薬品管理局(National Medical Products Administration)のルールに沿ったPV能力を必要とするグローバルクライアントを引き寄せています。日本のAI医薬品安全性研究助成金(AMED)のような政府投資プログラムは、国内のソフトウェア採用をさらに刺激しています。多様な法的枠組みがあるにもかかわらず、アジア太平洋地域の規制当局の多くは現在ICH E2B(R3)XMLを受け入れており、ローカライゼーションの障壁を減らしています。
欧州では、ファーマコビジランス義務やGDPRが成熟し、設定可能で監査対応可能なプラットフォームの必要性が高まっているため、大きな規模を維持しています。欧州健康データスペース規制は、健康データの二次利用を正式化し、スポンサーにきめ細かな同意管理が可能なソフトウェアの採用を促しています。ドイツの新しいDigital Actは、非識別化された請求データセットを調査用に開放し、安全性アルゴリズムが、かつては立ち入り禁止であった国家リポジトリをマイニングできるようにします。しかし、厳格なデータ主権条項はEUベースのホスティングを要求しており、地域固有のクラウド・ゾーンの需要に拍車をかけています。このような力学を総合すると、アジア太平洋地域より成長が遅れているとはいえ、欧州は機能豊富なプラットフォームのプレミアム市場であることに変わりはないです。
その他の特典:
- エクセル形式の市場予測(ME)シート
- 3ヶ月間のアナリストサポート
よくあるご質問
目次
第1章 イントロダクション
- 調査の前提条件と市場の定義
- 調査範囲
第2章 調査手法
第3章 エグゼクティブサマリー
第4章 市場情勢
- 市場概要
- 市場促進要因
- 薬物有害反応(ADR)の発生率の上昇
- 厳格なグローバルE2B(R3)/IDMPコンプライアンス期限
- 安全性データベースのクラウドファースト移行
- 概要可能なAIモジュールがケース処理コストを大幅に削減
- 早期シグナルのためのリアルワールドエビデンス(RWE)統合
- 新興市場向けフォームのローコードローカリゼーション
- 市場抑制要因
- データ主権と国境を越えた移転の制限
- PVデータサイエンス人材の不足
- アルゴリズムバイアスの精査がAI承認を遅らせる
- 主要DBベンダーによるAPI価格の高騰
- サプライチェーン分析
- 規制情勢
- テクノロジーの展望
- ポーターのファイブフォース分析
- 新規参入業者の脅威
- 買い手の交渉力
- 供給企業の交渉力
- 代替品の脅威
- ライバル関係の激しさ
第5章 市場規模と成長予測
- 機能性別
- 有害事象報告ソフトウェア
- 医薬品安全性監査ソフトウェア
- 問題追跡ソフトウェア
- 完全に統合された安全スイート
- シグナル検出とリスク管理ツール
- 配送方法別
- オンプレミス
- クラウド/SaaS
- ハイブリッド展開
- エンドユーザー別
- 製薬・バイオテクノロジー企業
- 契約調査機関(CRO)
- ビジネスプロセスアウトソーシング(BPO)企業
- 医療機器メーカー
- その他のPVサービスプロバイダー
- 地域
- 北米
- 米国
- カナダ
- メキシコ
- 欧州
- ドイツ
- 英国
- フランス
- イタリア
- スペイン
- その他欧州地域
- アジア太平洋地域
- 中国
- 日本
- インド
- 韓国
- オーストラリア
- その他アジア太平洋地域
- 中東・アフリカ
- GCC
- 南アフリカ
- その他中東・アフリカ地域
- 南米
- ブラジル
- アルゼンチン
- その他南米
- 北米
第6章 競合情勢
- 市場集中度
- 市場シェア分析
- 企業プロファイル
- Oracle Corporation
- ArisGlobal
- Veeva Systems
- Sparta Systems
- IQVIA
- Ennov Solutions
- Extedo GmbH
- AB Cube
- Anju Software
- Sarjen Systems
- United BioSource Corp.
- Accenture
- Cognizant
- Tata Consultancy Services(TCS ADD)
- Parexel International
- Medidata Solutions
- Saama Technologies
- Intellimed(Vigilance 360)


