
|
市場調査レポート
商品コード
1836685
受託研究機関(CRO):市場シェア分析、産業動向、統計、成長予測(2025年~2030年)Contract Research Organization - Market Share Analysis, Industry Trends & Statistics, Growth Forecasts (2025 - 2030) |
||||||
カスタマイズ可能
適宜更新あり
|
|||||||
| 受託研究機関(CRO):市場シェア分析、産業動向、統計、成長予測(2025年~2030年) |
|
出版日: 2025年06月30日
発行: Mordor Intelligence
ページ情報: 英文 115 Pages
納期: 2~3営業日
|
概要
受託研究機関(CRO)の市場規模は2025年に858億8,000万米ドルと推定され、予測期間(2025~2030年)のCAGRは8.27%で、2030年には1,277億7,000万米ドルに達すると予測されます。
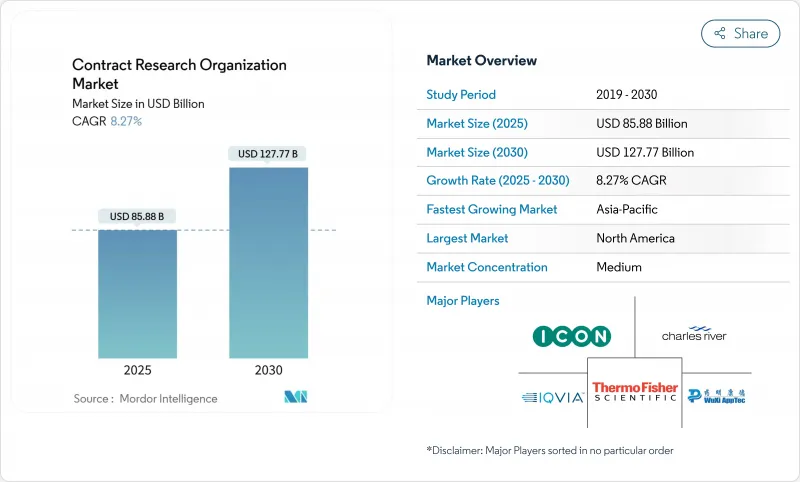
堅調な拡大は、バイオ医薬品の研究開発予算の増加、アセットライトオペレーションモデルへのシフト、スポンサーが増大する開発コストを管理できる柔軟なアウトソーシングフレームワークへの需要に起因します。オンコロジープログラムが収益の大半を占める一方、各国政府がパンデミック対策に資金を提供する中、感染症研究が加速しています。大手スポンサーはデジタル試験プラットフォームを標準化し、小規模バイオテク企業はニッチなCRO能力に依存する精密医療プロトコルを推進しています。アジア太平洋地域は、合理化された規制と低運営コストでグローバルスポンサーを惹きつけ、二桁成長を記録しているが、手数料収入への貢献は北米が依然として最大です。ファンクショナル・サービス・プロバイダー(FSP)契約は、コストをより明確に把握できるため台頭しつつあるが、複雑な国際共同治験ではフルサービス契約が不可欠であることに変わりはないです。特に臨床研究アソシエイト(CRA)の人材不足が深刻化し、ICH E6(R3)に関連するデータ管理コストが高騰しているため、当面の営業利益率は低下する可能性があります。
世界の受託研究機関(CRO)市場の動向と洞察
バイオ医薬品企業による研究開発活動の拡大
マクロ経済の逆風にもかかわらず、世界のバイオ医薬品研究開発費は2024年に2,880億米ドルに増加。大手医薬品メーカーは、特許切れが近づくにつれてパイプラインの更新に過去最高の予算を振り向け、より利益率の高い資産を求めて外部開発パートナーへの依存度を高めています。CROは、スポンサーが初期の安全性試験や後期の運営ロジスティクスをオフロードすることで利益を得る。プレシジョン・メディシン・プロジェクトは高度なバイオマーカー戦略を必要とするため、ラボとデータサイエンスサービスを統合したプロバイダーへの需要が高まる。持続的な投資サイクルは、差別化されたサービスラインの価格決定力を支える安定した長期バックログを示唆しています。
臨床試験数の増加
産業界がスポンサーとなった臨床試験の完了件数は、2024年には前年比10.7%増の4,295件となりました。がん領域が主導権を維持するも、2023年にはがん領域における中国の臨床試験シェアが60%に急増。スポンサーは、より迅速な登録と低コストを求めて新興市場に引き寄せられ、CROはアジア太平洋地域での事業規模を拡大します。試験件数の拡大により、データ管理プラットフォームや遠隔モニタリング技術に対する需要が高まり、試験実施施設のパフォーマンスが向上します。多言語のプロジェクトチームを動員し、多様な規制レジームへの対応が可能なプロバイダーは、タイムラインのリスク軽減を求めるグローバルクライアントから継続的なビジネスを獲得しています。
グローバルなCRA人材不足
臨床研究業界は深刻な人材危機に直面しており、がん研究センターの95%が、臨床試験の質を低下させ、研究開発を遅らせる人材不足の問題を報告しています。未充足のポジションは人件費予算を膨らませ、治験開始のマイルストーンを遅らせる。一部のCROは、加速トレーニングアカデミーや事前に適格とされた候補者プールを展開し、オンボーディングコストを月1万~5万米ドル削減しています。しかし、教育カリキュラムが臨床研究キャリアに焦点を当てることが少ないため、人材不足は続いています。人材不足は定員増を制限し、医療提供者が新たな研究を受け入れるペースを制約する可能性があります。
レポートで分析されているその他の促進要因と抑制要因
- アウトソーシングとコスト削減の動向
- 慢性疾患と複雑な疾患の有病率の増加
- データセキュリティと機密保持のリスク
セグメント分析
2024年の受託研究機関(CRO)市場規模は、臨床研究サービスが総収入の61.45%を占め、後期開発の専門知識の重要性が確認されました。しかし、アーリーフェーズ開発の売上は2030年までにCAGR 10.72%で増加すると予測されており、これはサービスカテゴリーの中で最速です。スポンサーは、第I相試験のスペシャリストを活用し、ヒトに初めて投与された安全性データを作成することで、アセット進行のリスクを軽減しています。デジタル試験シミュレーターと適応型プロトコールデザインはサイクルタイムを短縮し、統合バイオ分析ラボは早期段階の意思決定をサポートするリアルタイムのPK/PD読み出しを提供します。
主要なCROは過去5年間に250件以上の第I相試験を完了したが、これは微量投与、食効、薬物-薬物相互作用評価に対する需要の高まりを反映しています。前臨床毒性学から第I相臨床試験へのシームレスな移行を提供するプロバイダーは、増分収益を獲得し、顧客維持を強化します。Trial PathfinderのようなAI主導のツールは、電子カルテネットワーク内で適格な被験者を特定し、登録期間を最大30%短縮します。このような効率化がこのセグメントの力強い成長軌道を支え、より広範な受託研究機関(CRO)市場における戦略的重要性を強化しています。
オンコロジーは2024年に受託研究機関(CRO)市場の21.43%を占め、1万件を超える活発な調査に支えられています。プレシジョン・オンコロジーのプロトコールでは、ゲノム配列の決定、コンパニオン診断、検体収集の分散化などが必要となり、業務が複雑化しています。腫瘍学に特化したデータレイクや分子プロファイリングラボを持つCROは、チェックポイント阻害剤や次世代CAR-T療法を進める大手製薬会社のパイプラインから繰り返しプロジェクトを獲得しています。
感染症臨床試験は、スポンサーが抗菌薬耐性とパンデミック対策資金に対応するため、CAGR 10.81%を記録すると予測されます。BSL-3ラボとワクチン試験の経験を持つプロバイダーは、多国籍パートナーシップを惹きつける。中枢神経系と心血管系試験は一桁台半ばの成長を遂げ、遺伝子治療の革新に牽引された希少疾患ポートフォリオは、希少疾病指定のインセンティブをうまく利用できるCROに高収益の機会を提供しています。治療ミックスの変化は、医療、規制、業務の各分野の専門家を1つのガバナンス・モデルに統合する治療領域エクセレンス・プログラムへの投資を促しています。
地域別分析
北米は、高価値生物製剤の豊富なパイプラインとFDAガイダンスの合理化によりプロトコール修正のリスクが軽減され、2024年の世界売上高の38.92%を占めました。先進的な治験施設インフラと熟練した治験責任医師は、高いデータ品質スコアにつながり、フルサービス契約のプレミアム価格を維持しています。しかし、コスト圧力とリクルートの課題により、スポンサーは治験施設ネットワークを海外に拡大する傾向にあります。
アジア太平洋地域のCAGRは11.26%で、これは世界最速です。中国と韓国の規制当局が、早期承認の枠組みを採用し、試験開始までの期間を短縮しています。腫瘍学とワクチン研究に対する政府助成金は、活動の拠点をさらに東に傾けています。現地の言語に精通し、グローバル品質のデータシステムを持つCROは、複数の国からの委託を獲得しています。欧州はCTR536/2014に基づくハーモナイゼーションが進行する中、緩やかな成長を維持しているが、一部のスポンサーは開始時期の長期化に不満を抱いており、倫理審査委員会の動きが早い中東欧に初期段階の仕事を振り向けるよう促しています。
南米は、多様な患者集団が存在する費用対効果の高い選択肢であり、ファーマコビジランス体制の強化により、世界のスポンサーの信頼が向上しています。中東・アフリカはまだ発展途上であるが、湾岸地域の第3次医療機関が拡大するにつれて、パイロット的な腫瘍学および希少疾患プログラムが注目されています。全体として、地理的多様化はリクルートリスクを軽減し、既存地域がキャパシティやコストの制約に直面しても、受託研究機関(CRO)市場が二桁成長を維持することを保証しています。
その他の特典
- エクセル形式の市場予測(ME)シート
- 3ヶ月のアナリストサポート
よくあるご質問
目次
第1章 イントロダクション
- 調査の前提条件と市場定義
- 調査範囲
第2章 調査手法
第3章 エグゼクティブサマリー
第4章 市場情勢
- 市場概要
- 市場促進要因
- バイオ医薬品企業による研究開発活動の拡大
- 臨床試験数の増加
- CROサービスの利用によるアウトソーシングとコスト削減の動向の高まり
- 慢性疾患や複雑な疾患の増加
- 個別化医療の成長
- 市場抑制要因
- 世界のCRA人材不足による人件費の高騰
- 規制および倫理的課題
- データセキュリティと機密保持リスク
- 規制の見通し
- ファイブフォース分析
- 新規参入業者の脅威
- 供給企業の交渉力
- 買い手の交渉力
- 代替品の脅威
- 業界のライバル関係
第5章 市場規模・成長予測(金額)
- サービスタイプ別
- 初期段階開発サービス
- 臨床研究サービス
- フェーズi
- フェーズII
- フェーズIII
- フェーズIV
- ラボサービス
- コンサルティングサービス
- 治療領域別
- がん領域
- 感染症
- 中枢神経系(CNS)疾患
- 免疫疾患
- 心血管疾患
- 呼吸器疾患
- 糖尿病
- その他の治療領域
- エンドユーザー別
- 製薬・バイオ製薬企業
- 医療機器メーカー
- その他エンドユーザー(学術・政府機関)
- 提供モデル別
- フルサービス/統合型CRO
- ファンクショナル・サービス・プロバイダー(FSP)
- ハイブリッド/モジュラーモデル
- 地域別
- 北米
- 米国
- カナダ
- メキシコ
- 欧州
- ドイツ
- 英国
- フランス
- イタリア
- スペイン
- その他欧州
- アジア太平洋
- 中国
- 日本
- インド
- オーストラリア
- 韓国
- その他アジア太平洋地域
- 中東・アフリカ
- GCC
- 南アフリカ
- その他中東とアフリカ
- 南米
- ブラジル
- アルゼンチン
- その他南米
- 北米
第6章 競合情勢
- 市場集中度
- 戦略的動向
- 市場シェア分析
- 企業プロファイル
- IQVIA Holdings Inc.
- Fortrea
- ICON plc
- Charles River Laboratories
- Parexel International(MA)Corporation
- Syneos Health
- Thermo Fisher Scientific Inc.(PPD Inc.)
- Medpace, Inc.
- WuXi AppTec(WuXi Clinical)
- Pharmaron
- SGS Societe Generale de Surveillance SA
- Eurofins Scientific
- PSI
- Syngene International Limited
- Inotiv
- CRITERIUM, INC.
- Evotec SE
- BioAgile Therapeutics Private Limited
- Tigermed
- Worldwide Clinical Trials


