
|
市場調査レポート
商品コード
1836532
マイコプラズマ検査:市場シェア分析、産業動向、統計、成長予測(2025年~2030年)Mycoplasma Testing - Market Share Analysis, Industry Trends & Statistics, Growth Forecasts (2025 - 2030) |
||||||
カスタマイズ可能
適宜更新あり
|
|||||||
| マイコプラズマ検査:市場シェア分析、産業動向、統計、成長予測(2025年~2030年) |
|
出版日: 2025年06月24日
発行: Mordor Intelligence
ページ情報: 英文 120 Pages
納期: 2~3営業日
|
概要
マイコプラズマ検査市場規模は2025年に11億3,000万米ドルと推定・予測され、予測期間中(2025~2030年)のCAGRは11.27%で、2030年には19億3,000万米ドルに達すると予測されます。
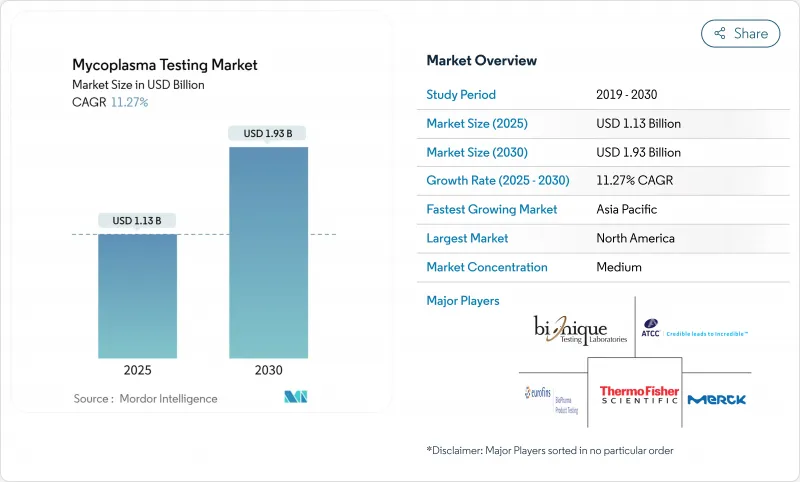
生物製剤製造に対する規制当局の監視の強化、細胞・遺伝子治療生産の拡大、迅速な核酸法への嗜好の高まりが、この軌道を支えています。FDAとEMAに代表される規制機関は、製品ライフサイクルの複数の時点で有効なマイコプラズマ検出を要求しており、バイオメーカーにとってコンプライアンスは非裁量的な支出になっています。デジタルPCRと自動化されたsample-to-answerプラットフォームは、ロットリリースのタイムラインを加速し、一方、アウトソーシングの動向は、迅速な能力拡張が可能な受託機関に検査業務を移管しています。中国、インド、シンガポールにおける地域的な製造業の拡大は、税制優遇措置と相まってラボの増設に拍車をかけているが、熟練した分子QA担当者の不足と高い自動化コストが小規模施設での採用率を抑えています。競合は、機器、キット、サービスをバンドルし、クロスセリングの可能性を高め、顧客との関係を強化できるベンダーに有利です。
世界のマイコプラズマ検査市場の動向と洞察
バイオ医薬品および細胞・遺伝子治療製造施設の拡大
自家および同種療法工場の生産能力増強により、100%バッチ検査を必要とするサンプル量が増加しています。細胞培養におけるコンタミネーション有病率は、15%から35%であり、FDAガイダンスは、現在、プーリング後、洗浄前のマイコプラズマ検査を義務付けており、サンプリング頻度が増加しています。連続灌流バイオリアクターはリアルタイムのモニタリングの必要性を高め、最小限の人的介入でより高いスループットを処理する自動分析装置の需要を押し上げています。新興市場での施設展開は適格性試験を完了する必要があり、サードパーティの試験サービスに対するグリーンフィールド需要を生み出します。これらの動向を合計すると、予測CAGRは2.8ポイント上昇します。
生物製剤に対するマイコプラズマ放出試験の規制義務化
FDAの検査室開発試験規則とEMAの先端治療薬開発ガイダンスでは、マスターセルバンクから最終医薬品に至るまで有効なアッセイを要求しています。欧州医薬品庁(EMA)の先進治療薬に関するガイドラインは、マスターセルバンクから最終製品のリリースに至るまで、製造工程全体で包括的なマイコプラズマ検査を義務付けています。このような規制の変更は、メーカーが検証された方法によってマイコプラズマが存在しないことを証明しなければ製品をリリースできないため、検査サービスに対する非裁量的な需要を生み出します。新しいLDT規制が4年かけて段階的に実施されることにより、検査施設がコンプライアンスを維持するために検査能力をアップグレードするため、予測可能な需要の伸びが生まれます。
自動検出システム導入のための高額な設備投資
エントリーレベルの自動分析装置は100,000~50万米ドルで、年間サービス契約は5万米ドルを超えます。小規模のCTLやアカデミックラボでは、このような出費を正当化するのに苦労し、手動の培養法への依存を長引かせています。FDAのLDTコンプライアンスは、バリデーションコストを追加し、資本予算を圧迫するため、短期的な普及を抑制します。小規模の検査受託施設は、その限られたサンプル量と多様な検査要件から、自動化投資を正当化する上で、特に課題に直面しています。規制遵守のための自動化システムのバリデーションの複雑さは、バリデーション研究に通常6~12ヶ月を要し、専門的な専門知識を必要とするため、多大な時間とコスト負担を強います。
レポートで分析されているその他の促進要因と抑制要因
- 細胞培養汚染事例の増加
- 迅速な高感度PCRベースアッセイへの需要の高まり
- 偽陽性/陰性の再検査の遅延
セグメント分析
キットと試薬は2024年に46.17%のシェアを維持し、マイコプラズマ検査市場における消耗品としての性質を強調しています。バイオメーカーがメソッドのバリデーションやルーチンスクリーニングを認定ラボに委ねるため、サービスセグメントはCAGR14.68%で拡大します。高い規制ハードルと進化するアッセイフォーマットにより、企業はキャパシティを構築する代わりに専門家のキャパシティを購入するようになっています。ユーロフィンズの45カ所以上の世界的な拠点網は、個々の企業では再現できないコスト効率を、いかに規模が生み出すかを示しています。
自動化対応機器は、購入者が試薬の長期契約に縛られることが多いため、着実ではあるが成長は緩やかです。BIOFIREプラットフォームとRapid Micro Biosystemsのバイアルリーダーは、スピードと薬局方コンプライアンスを融合させることでアピールしています。サービスが成長するにつれ、キットベンダーは試薬レンタルモデルでサードパーティラボと連携し、供給収益を確保するようになります。この相乗効果により、買い手と供給者の依存関係が強化され、両カテゴリーの数量が増加します。
qPCRは2024年のマイコプラズマ検査市場シェアの64.39%を占める。デジタルPCRは16.26%の成長率で、標準曲線エラーを軽減し、遺伝子治療ロットに不可欠な稀なイベントを検出します。感度の向上は、確実な定量を求める規制監査官と共鳴します。従来のPCR法は、レガシーな施設では依然として低コストの選択肢であり、ELISA法とDNA染色法は、ニッチな学術的アプリケーションでは依然として適切です。次世代シーケンサーは、多重病原体スクリーニングを約束するが、規制当局のコンセンサスを待っています。
規制機関は現在、培養と同等の核酸法をリリース検査に認めており、デジタルPCRの普及を促しています。機器メーカーは、反応混合物を数千のパーティションにスライスし、検出しきい値を下げるマイクロ流体チップフォーマットに投資しています。AIの増強はさらにオペレーターのスキルの障壁を軽減し、より広範なラボでの採用を可能にします。
地域別分析
北米は、FDAの監督、成熟したバイオプロセシングインフラ、早期技術導入が安定した需要を下支えし、2024年の売上高の40.81%を占め首位となりました。この地域のバイオクラスター密度と資本の利用可能性は、培養法から自動PCRシステムへの迅速な置き換えを促しています。サービスプロバイダーはイノベーターに近いという利点を生かし、ジャストインタイムのサンプル物流とコンプライアンス監査を可能にしています。
欧州はEMAによる一貫した規制の枠組みと、複数国でのロットリリースを容易にするハーモナイゼーションされた薬局方で追随しています。マイコプラズマ検査市場の規模は、ドイツ、スペイン、英国がGMP施設を保有しているように、EUの遺伝子治療試験と関連しています。ベンダーは多言語での文書化とシリアル化の要求に応え、インフォマティクス対応のアッセイプラットフォームに拍車をかけています。
アジア太平洋地域は最も急成長している地域で、CAGR18.62%で拡大しています。中国の細胞療法セクターは政府による優先リストの恩恵を受けており、インドの生産連動型インセンティブ制度はワクチン輸出業者を惹きつけています。シンガポールの分散型QCラボは、地域の生物製剤工場の納期を短縮します。規制が細分化されているため、現地でのバリデーションが必要となり、サービスハブを併設するグローバル企業が有利となります。
南米と中東・アフリカは、絶対的な収益では後塵を拝しているが、国内のワクチン・プログラムやバイオシミラー工場の急増に伴い、未開拓のアップサイドを提供しています。ロジスティクスのハードルと限られたコールドチェーン・インフラが迅速PCR装置の普及を遅らせているが、トレーニングやサービス・ネットワークが成熟すれば、公衆衛生への投資が将来の受注を引き出す可能性があります。
その他の特典:
- エクセル形式の市場予測(ME)シート
- 3ヶ月間のアナリストサポート
よくあるご質問
目次
第1章 イントロダクション
- 調査の前提条件と市場定義
- 調査範囲
第2章 調査手法
第3章 エグゼクティブサマリー
第4章 市場情勢
- 市場概要
- 市場促進要因
- バイオ医薬品および細胞・遺伝子治療(CGT)製造施設の拡大
- 生物製剤に対するマイコプラズマ放出試験の規制義務化
- 細胞培養汚染の増加
- 迅速で高感度なPCRベースのアッセイに対する需要の高まり
- 新興バイオテクノロジーハブにおける分散型QCラボ
- ベンチャーキャピタルの支援による合成生物学スタートアップの急増
- 市場抑制要因
- 自動検出システム導入のための高額な設備投資(CAPEX)
- 偽陽性/陰性の再検査の遅延
- 熟練した分子QA人材の不足
- マイクロ流体アッセイと次世代アッセイの承認を取り巻く規制の遅れ
- ポーターのファイブフォース分析
- 新規参入業者の脅威
- 買い手の交渉力
- 供給企業の交渉力
- 代替品の脅威
- 競争企業間の敵対関係の強さ
第5章 市場規模・成長予測(単位:米ドル)
- 製品・サービス別
- 機器
- リアルタイムPCRシステム
- 迅速マイクロ流体分析装置
- 自動検出プラットフォーム
- その他の装置
- キット&試薬
- PCRアッセイキット
- ELISAキット
- 酵素アッセイキット
- 蛍光試薬
- その他
- サービス
- 機器
- 技術別
- コンベンショナルPCR
- qPCR
- デジタルPCR
- ELISA法
- 酵素法
- DNA染色
- 次世代シーケンス
- その他のNAAT
- 用途別
- 細胞ラインの品質管理
- 生物生産バッチリリース検査
- 原材料・培地検査
- 遺伝子・細胞治療製造
- ワクチン・ウイルス検査
- その他の用途
- エンドユーザー別
- バイオ医薬品・バイオテクノロジー企業
- 製造受託機関(CMO)
- 学術・研究機関
- 細胞バンク&リポジトリ
- 診断・リファレンス研究所
- 地域別
- 北米
- 米国
- カナダ
- メキシコ
- 欧州
- ドイツ
- 英国
- フランス
- イタリア
- スペイン
- その他欧州
- アジア太平洋
- 中国
- 日本
- インド
- オーストラリア
- 韓国
- その他アジア太平洋地域
- 中東・アフリカ
- GCC
- 南アフリカ
- その他中東とアフリカ
- 南米
- ブラジル
- アルゼンチン
- その他南米
- 北米
第6章 競合情勢
- 市場集中度
- 市場シェア分析
- 企業プロファイル
- Thermo Fisher Scientific Inc.
- Charles River Laboratories Intl. Inc.
- Merck KGaA
- Lonza Group Ltd.
- Eurofins Scientific SE
- Sartorius AG
- Agilent Technologies
- ATCC
- PromoCell GmbH
- Minerva Biolabs GmbH
- bioMerieux SA
- Bionique Testing Laboratories Inc.
- WuXi AppTec
- SGS SA
- Danaher Corporation
- Rapid Micro Biosystems
- MicroBioLogics Inc.
- InvivoGen
- Mycoplasma Experience Ltd.


