|
|
市場調査レポート
商品コード
1738505
世界のmRNAがんワクチンの臨床試験動向:適応症別市場動向、開発優先順位、市場の機会(2025年)Global mRNA Cancer Vaccines Clinical Trials, Market Trends By Indication, Development Priority Status & Market Opportunity Insight 2025 |
||||||
|
|||||||
| 世界のmRNAがんワクチンの臨床試験動向:適応症別市場動向、開発優先順位、市場の機会(2025年) |
|
出版日: 2025年05月01日
発行: KuicK Research
ページ情報: 英文 150 Pages
納期: 即日から翌営業日
|
全表示
- 概要
- 図表
- 目次
世界のmRNAがんワクチンの臨床試験動向:適応症別市場動向、開発優先順位、市場の機会(2025年)のレポートハイライト
- 臨床試験中のmRNAがんワクチンに関する洞察:>60種以上のmRNAがんワクチン
- mRNAがんワクチンの臨床試験に関する洞察:企業別、国別、適応症別、相別
- 主要ワクチンの臨床試験開始年および完了年に関する洞察
- 進行中の市場提携、取引、投資のシナリオ
- mRNAがんワクチン開発のための独自技術と調査手法
- 地域別・適応症別の市場開拓動向
- 競合情勢
mRNAがんワクチンの領域は、現代の薬学において最も急速に発展している領域のひとつとなっています。COVID-19パンデミックにおけるmRNA技術の成功に後押しされ、製薬業界や研究開発機関は現在、このプラットフォームを活用して高度に個別化された抗がん剤治療を開発しています。不正確で全身毒性を引き起こしがちな従来の治療法とは異なり、mRNAがんワクチンは、個々の腫瘍に存在する特定の遺伝子変異に応じた標的免疫療法を提供します。このような特異性は、腫瘍学の標準治療を再定義する可能性を秘めています。
臨床面では、60を超えるmRNAがんワクチン候補がさまざまな段階で開発中です。そのほとんどは予備研究や前臨床開発段階にあるが、すでに中期・後期臨床試験段階にあるものもいくつかあります。mRNAがんワクチンは従来のワクチンとは異なり、個々の患者の腫瘍パターンに合わせてカスタマイズすることができます。
現在開発中の最先端のmRNAがんワクチンのひとつが、メラノーマと非小細胞肺がん(NSCLC)を対象にフェーズ3段階にある、ModernaとMerckのIntismeran Autogene(mRNA-4157/V940)です。このワクチンは、免疫チェックポイント阻害剤であるペムブロリズマブと併用投与され、免疫によるがん細胞の認識と殺傷を最大化します。この併用療法は、免疫活性化を最適化し、耐性メカニズムを破壊することを目的としています。成功の暁には、両社は2027年第2四半期までにIntismeran Autogeneの商業化を目指しています。
Memorial Sloan Kettering Cancer Centerと提携したBioNTechのオートジェンセブメラン(BNT122)も、最近、膵臓がんで有望な第1相試験結果を示しています。初期の2025年のデータでは、ワクチンによって誘導された免疫細胞は一部の患者でほぼ4年間持続しました。ワクチンに反応した患者は無再発期間が長く、これは長期間持続する腫瘍特異的T細胞反応の発達を示唆しました。
mRNAがんワクチンに対する商業的関心も高まっています。大手バイオテクノロジー企業や大手製薬会社は、研究開発に数十億米ドルを投資しています。その上、新世代のバイオテクノロジー新興企業が、新しい抗原ターゲティング方法、デリバリー戦略、ワクチン製造方法を用いて臨床試験を開始しています。トリプルネガティブ乳がんなどの悪性腫瘍に関連するタンパク質であるTROP2に対するCKライフサイエンスの円形mRNAベースのワクチンは、有望な開発です。動物モデルでの前臨床試験では、ほぼ完全な腫瘍抑制効果が得られました。
熱意は伝わってきますが、mRNAがんワクチンはいずれもまだ規制当局の承認を受けていないことを述べておかなければなりません。とはいえ、その道のりは急速であり、規制当局もそれに合わせて適応しています。FDA、EMA、英国のMHRAなどの組織は、個別化免疫療法に対応するためのガイドラインを熱心に定義しています。NHSのCancer Vaccine Launch Padは、そのような開発の実例であり、イングランド全土で個別化ワクチンの治験のために患者を募集しています。
世界中で60以上のmRNAがんワクチン候補が開発中であり、臨床試験の後期段階にあるものもあることから、これらの治療法が腫瘍学に革命をもたらす可能性は大きいです。特に規制当局による承認や大量生産に課題があるもの、生物工学、ゲノム科学、免疫療法の相乗効果により、がんワクチンが最も恩恵を受けるであろう個人に個別化される日も近いかもしれません。
当レポートは、世界のmRNAがんワクチンの臨床試験市場について調査し、市場の概要とともに、薬剤動向、臨床試験動向、地域別動向、および市場に参入する企業の競合情勢などを提供しています。
目次
第1章 次世代がん免疫療法としてのmRNAワクチン
- mRNAワクチンの概要
- mRNAワクチンと他のがん治療法の比較
- mRNAワクチンと他のワクチンの比較
第2章 世界のmRNAがんワクチン市場概要
- 現在の市場動向
- 将来の市場商業化と臨床機会
第3章 世界のmRNAがんワクチン臨床試験の洞察、企業、国、適応症、相別
- 調査
- 前臨床
- 第I相
- 第I/II相
- 第II相
- 第II/III相
- 第III相
第4章 世界のがんmRNAワクチンの臨床パイプラインの概要
- 企業別
- 国別
- 適応症別
- 患者セグメント別
- 相別
- 優先ステータス別
第5章 mRNAがんワクチンの臨床情勢、適応症別
- 乳がん
- 脳腫瘍
- 黒色腫
- 頭頸部がん
- 肺がん
- 子宮頸がん
- 消化器がん
第6章 mRNAがんワクチン市場動向、国別
- 米国
- 中国
- オーストラリア
- 欧州
- カナダ
- 英国
第7章 世界のmRNAがんワクチン市場における提携、取引、投資
第8章 mRNAがんワクチン開発のための独自の技術と方法論
第9章 競合情勢
- BioNTech
- Combined Therapeutics
- CureVac
- EpiVax
- HDT Bio
- Immorna
- Immune Design
- MDimune
- Moderna Therapeutics
- NeoCura
- pHion Therapeutics
- Providence Therapeutics
- RinuaGene
- RNAimmune
- TransCode Therapeutics
List of Figures
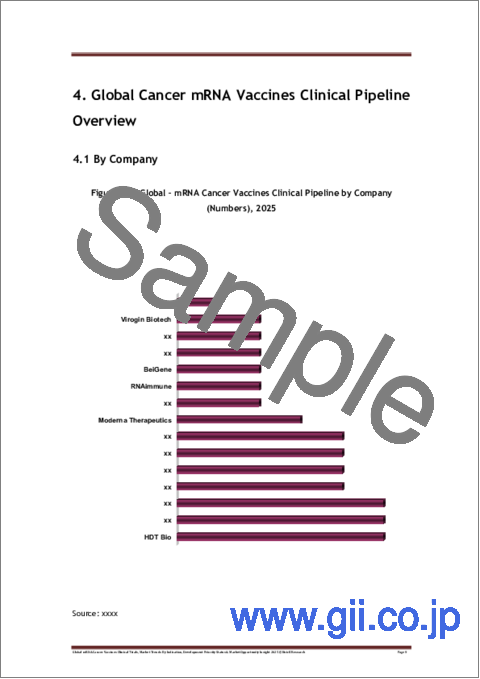
- Figure 4-1: Global - mRNA Cancer Vaccines Clinical Pipeline by Company (Numbers), 2025
- Figure 4-2: Global - Number Of mRNA Cancer Vaccines Trials by Country (Numbers), 2025
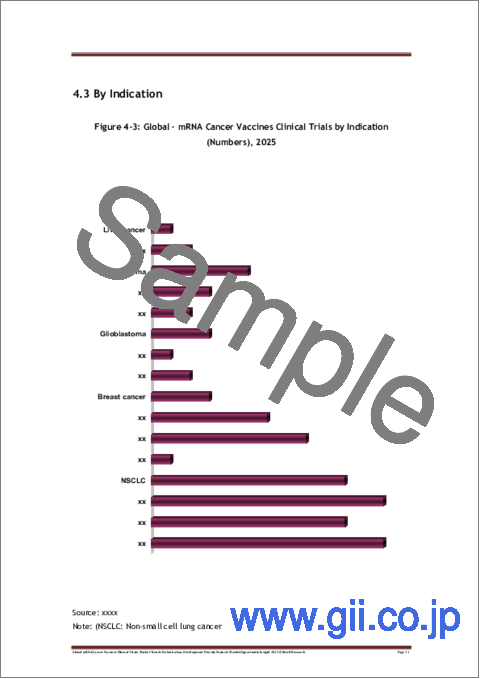
- Figure 4-3: Global - mRNA Cancer Vaccines Clinical Trials by Indication (Numbers), 2025
- Figure 4-4: Global - mRNA Cancer Vaccines Clinical Pipeline by Patient Segment (Numbers), 2025
- Figure 4-5: Global - mRNA Cancer Vaccines Clinical Pipeline by Phase (Numbers), 2025
- Figure 4-6: Global - mRNA Cancer Vaccines Clinical Pipeline by Priority Status (Numbers), 2025
- Figure 5-1: KEYNOTE-603 Phase I (NCT03313778) Study - Initiation & Completion Year
- Figure 5-2: Autogene Cevumeran Phase I (NCT03289962) Study - Initiation & Completion Year
- Figure 5-3: CVGBM Phase I (NCT05938387) Study - Initiation & Completion Year
- Figure 5-4: Autogene Cevumeran Phase I (NCT03289962) Study - Initiation & Completion Year
- Figure 5-5: BNT111 Phase I (NCT04526899) Study - Initiation & Completion Year
- Figure 5-6: mRNA-4157 Phase II (NCT03897881) Study - Initiation & Completion Year
- Figure 5-7: mRNA-4157 Phase III (NCT05933577) Study - Initiation & Completion Year
- Figure 5-8: BNT113 Phase II (NCT04534205) Study - Initiation & Completion Year
- Figure 5-9: mRNA-4157 Phase I (NCT03313778) Study - Initiation & Completion Year
- Figure 5-10: V940 Phase III (NCT06077760) Study - Initiation & Completion Year
- Figure 5-11: LuCa-MERIT-1 Phase I (NCT05142189) Study - Initiation & Completion Year
- Figure 5-12: EMPOWERVAX Lung 1 Phase I (NCT05557591) Study - Initiation & Completion Year
- Figure 5-13: Autogene Cevumeran Phase I (NCT04161755) Study - Initiation & Completion Year
- Figure 5-14: Autogene cevumeran Phase II (NCT05968326) Study - Initiation & Completion Year
- Figure 5-15: BNT122 Phase II (NCT04486378) Study - Initiation & Completion Year
- Figure 8-1: BioNTech - uRNA products
- Figure 8-2: BioNTech - iNeST technology
- Figure 8-3: CureVac - CureVac Method for Generation of mRNA Therapeutics
- Figure 8-4: Moderna - mRNA Technology
- Figure 8-5: NeoCura - NeoCura Ag Platform
- Figure 8-6: Providence Therapeutic - mRNA Medicines Platform Benefits
List of Tables
- Table 1-1: mRNA Vaccines v/s Other Cancer Therapeutic Approaches
- Table 1-2: mRNA-Based Cancer Vaccines vs. Other Cancer Vaccines
- Table 2-1: Regulatory Designations Granted to Investigational mRNA Cancer Vaccines
- Table 5-1: Breast Cancer - Some mRNA Vaccines in Clinical Trials
- Table 5-2: Brain Cancer - Some mRNA Vaccines in Clinical Trials
- Table 5-3: Melanoma - Some mRNA Vaccines in Clinical Trials
- Table 5-4: Head & Neck Cancer - mRNA Vaccines in Clinical Trials
- Table 5-5: Lung Cancer - Some mRNA Vaccines in Clinical Trials
- Table 5-6: Cervical Cancer - Some mRNA Vaccines in Clinical Trials
- Table 5-7: Gastrointestinal Cancers - Some mRNA Vaccines in Clinical Trials
Global mRNA Cancer Vaccines Clinical Trials, Market Trends By Indication, Development Priority Status & Market Opportunity Insight 2025 Report Highlights:
- Insight On mRNA Cancer Vaccines In Clinical Trials: > 60 mRNA Cancer Vaccines
- mRNA Cancer Vaccine Clinical Trials Insight By Company, Country, Indication & Phase
- Key Vaccines Initiation & Completion Year Insight
- Ongoing Market Collaborations, Deals & Investments Scenario
- Proprietary Technologies & Methodologies For mRNA Cancer Vaccine Development
- Market Development Trends By Region & Indications
- Competitive Landscape
mRNA cancer vaccine space has become one of the most rapidly evolving domains in modern pharmaceutical sciences. Encouraged by the success with mRNA technology during the COVID-19 pandemic, the pharmaceutical industry and research institutions are currently leveraging this platform to develop highly individualized anticancer therapies. Unlike conventional therapies, which tend to be imprecise and cause systemic toxicity, mRNA cancer vaccines provide targeted immunotherapy depending on the specific genetic mutations present in an individual tumor. Such specificity has the potential to redefine oncology standards of care.
On the clinical front, over 60 mRNA cancer vaccine candidates are under development at different stages. Though most of them are in preliminary research and preclinical development, a few are already in mid- and late stage clinical trials. These vaccines function by teaching the body to generate tumor-specific antigens, eliciting an immune response against cancer cells. mRNA cancer vaccines differ from conventional vaccines in that they can be customized to each individual patient's tumor pattern, a tactic which has already yielded encouraging results in enhancing long-term immune surveillance.
One of the most advanced mRNA cancer vaccine in the pipeline is Moderna and Merck's Intismeran Autogene (mRNA-4157/V940), currently in Phase 3 for melanoma and non-small cell lung cancer (NSCLC). The vaccine is given in combination with Pembrolizumab, an immune checkpoint inhibitor, to maximize immune recognition and killing of cancer cells. This combination approach is meant to optimize immune activation with breakage of resistance mechanisms. Upon a successful outcome, the firms seek to commercialize Intismeran Autogene by the second quarter of 2027.
Another top contender, Autogene cevumeran (BNT122), from BioNTech in partnership with Memorial Sloan Kettering Cancer Center, is also showed promising Phase 1 trial results in pancreatic cancer recently. Early 2025 data showed the vaccine-induced immune cells lasted in some patients for almost four years. Patients who responded to the vaccine had longer relapse-free periods, which suggested the development of long-lasting, tumor-specific T-cell responses.
Commercial interest in mRNA cancer vaccines is also heating up. Billions are being invested in R&D by large biotech companies and big pharma alike. On top of this, a new generation of biotech startups is going into clinical trials with new antigen targeting modalities, delivery strategies, and vaccine production methods. CK Life Sciences' circular mRNA-based vaccine for TROP2, a protein associated with aggressive tumors such as triple-negative breast cancer, is a promising development. Preclinical outcomes in animal models produced almost complete tumor suppression.
Although the enthusiasm is evident, it must be mentioned that none of the mRNA cancer vaccines have been approved by regulatory authorities yet. That said, the journey is rapid, and regulatory agencies are also adapting themselves in tune. Organizations like the FDA, EMA, and the MHRA of the UK are keenly defining guidelines to accommodate individualized immunotherapies. The NHS's Cancer Vaccine Launch Pad is a real-life example of such development, recruiting patients for individualized vaccine trials throughout England.
With more than 60 mRNA cancer vaccine candidates in development worldwide and some at late stages of clinical trials, the possibility of these treatments revolutionizing oncology is vast. Despite challenges, especially in approval by regulators and mass production, bioengineering, genomics, and immunotherapy synergy could soon bring cancer vaccines personalized to individuals who would benefit the most from them.
Table of Contents
1. mRNA Vaccines As Next Generation Cancer Immunotherapy
- 1.1 mRNA Vaccines Overview
- 1.2 mRNA Vaccines v/s Other Cancer Therapeutic Approaches
- 1.3 mRNA Vaccines v/s Other Vaccines
2. Global mRNA Cancer Vaccines Market Overview
- 2.1 Current Market Trends
- 2.2 Future Market Commercialization & Clinical Opportunities
3. Global mRNA Cancer Vaccine Clinical Trials Insight By Company, Country, Indication & Phase
- 3.1 Research
- 3.2 Preclinical
- 3.3 Phase I
- 3.4 Phase I/II
- 3.5 Phase II
- 3.6 Phase II/III
- 3.7 Phase III
4. Global Cancer mRNA Vaccines Clinical Pipeline Overview
- 4.1 By Company
- 4.2 By Country
- 4.3 By Indication
- 4.4 By Patient Segment
- 4.5 By Phase
- 4.6 By Priority Status
5. Global mRNA Cancer Vaccines Clinical Landscape By Indication
- 5.1 Breast Cancer
- 5.2 Brain Cancer
- 5.3 Melanoma
- 5.4 Head & Neck Cancers
- 5.5 Lung Cancer
- 5.6 Cervical Cancer
- 5.7 Gastrointestinal Cancers
6. Global mRNA Cancer Vaccines Market Trends By Country
- 6.1 US
- 6.2 China
- 6.3 Australia
- 6.4 Europe
- 6.5 Canada
- 6.6 UK
7. Global mRNA Cancer Vaccines Market Collaborations, Deals & Investments
8. Proprietary Technologies & Methodologies For mRNA Cancer Vaccine Development
9. Competitive Landscape
- 9.1 BioNTech
- 9.2 Combined Therapeutics
- 9.3 CureVac
- 9.4 EpiVax
- 9.5 HDT Bio
- 9.6 Immorna
- 9.7 Immune Design
- 9.8 MDimune
- 9.9 Moderna Therapeutics
- 9.10 NeoCura
- 9.11 pHion Therapeutics
- 9.12 Providence Therapeutics
- 9.13 RinuaGene
- 9.14 RNAimmune
- 9.15 TransCode Therapeutics